La Pila di Daniell, esatto, è proprio quella, l'avevo vista già tanto tempo fà ma nei libri di testo canonici viene presentata come pila primaria e poi con quella soluzione costruttiva del ponte salino che la rende un giocattolino, un soprammobile, difatti con il ponte salino (che nella pratica non ho la più pallida idea di come realizzare) la resistenza interna salta su nell'ordine dei khom, roba da pazzi!!
Mi dite vuoi che utilità pratica può avere una roba del genere? Ti insegnano la teoria che non ha alcuna attineza con la pratica, nessu fine utile, ma invece sotto si cela un uso pratico del passato, non solo teorie....
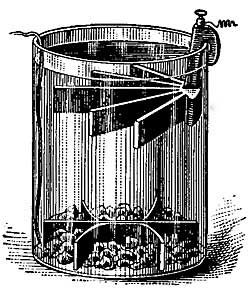
Così nessuno ti dice che questo tipo di cella realizzata nella forma "gravity cell", ovvero con separazione dei sali in soluzione per stratificazione, è stata una delle prime batterie ad alimentare le prime linee telegrafiche dei primi del '900, la sua vera forma robusta, ed in grado di alimentare qualcosa di pratico è questa:

Dimenticate il ponte salino e gli alambicchi da laboratorio, via via, ragioniamo su roba pratica ed utile a qualcosa

Economiche e facili da fare di sicuro, però come per ferro anche io ho difficoltà a trovare zinco puro, lo trovo solo come strato superficiale per le cose zincate, ma per fare delle prove posso rimediare con le pile scariche, smontandole dovrei ottenere il cilindro di zinco spero....
Comunque non capisco come il solfato di rame e il solfato di zinco si stratifichino in quel modo, per carità per fortuna che è così, ma leggendo su wikipedia il solfato di rame è meno denso del solfato di zinco e allora com'è possibile che resta sul fondo l'azzurro (solfato di rame) e non si mescolano o si scambiano posizione? Forse ho capito male qualcosa io....
Ad ongi modo, se ho capito bene la lezione di chimica, lo zinco si riduce creando nuovo solfato di zinco che è solubile e si mischia con l'acqua stratificandosi nella parte alta, il solfato di rame dimminuisce depositando rame metallico sul fondo, sull'elettrodo di rame.
Testeremo se ricaricando avviene il contrario, ovvero il rame rigenere solfato di rame e il solfato di zinco dimminuisce rigenerando zinco sull'elettrodo negativo.
E' importante evitare che l'elettrodo di zinco entri a contatto con lo strato azzurro della soluzione di solfato di rame se no è come mettere in corto l'elettrodo negativo e corrode lo zinco in quella parte generando rame su di esso.
E' ovvio che una cella del genere è solamente ad uso stazionario, se la si muove i due strati si mischiano e si scarica o smette di funzionare, però visto che nel nostro forum cerchiamo prevalentemente soluzioni di accumulo statiche per impianti ad isola nessuno vieta di fare le celle sul posto e poi evitare di scuoterle, giusto?
Leggendo diverse fonti ho notato ci sono tanti modi per realizzare la cella, uno in particolare mi ha incuriosito molto semplice, contenitore, elettrodo di rame sul fondo con la parte che sale verso l'alto isolata, cristallo di solfato sul fondo sopra il rame, elettrodo di zinco ben fissato in alto, versare acqua distillata.
Il cristallo azzurro di solfato di rame inizia a sciogliersi, si mette in corto per un periodo iniziale la cella così che lentamente lo zinco crea uno strato iniziale di solfato di zinco "rubando" un pò di solfato di rame dalla soluzione, dopo un corto iniziale di formazione la corrente dovrebbe salire e la cella è pronta per essere usata.
A parte la possibile reversibilità da testare, di questa cella elettrochimica mi intriga il fatto non indifferente che le materie attive sono liquide in soluzione, quindi credo di intuire che la sua capacità non è dovuta dalla superfice degli elettrodi ma da quanti litri di solfato di rame abbiamo e da quanti Kg di zinco pieno vi sono in cima, bisogna capire in quale rapporto ovviamente.
A differenza di altre soluzioni elettrochimiche come le piombo-acido, nichel-ferro, ecc.. dove ossidi, idrossidi e solfati non sono solubili e ricoprono la superfice delle piastre obbligando a creare superfici enormi con diverse tecniche, qui dovremmo in teoria semplificare le cose lavorando in peso e volume, l'unico neo è la resistenza interna poichè bisogna tenere una distanza minima tra rame e zinco per non far mischiare i due strati di soluzione e immagino che la cosa limiti la corrente massima di spunto.
Per la tensione di 1V non mi preoccupo, metteremo insieme più celle, basta che vi sia un minimo di reversibilità delle reazioni, e qui il fatto delle bollicine di gas per elettrolisi in fase di ricarica a cui fà riferimento Kekko potrebbero essere un problema, in quanto nelle piombo-acido hanno il potere di rimescolare l'elettrolita che si stratifica, ma a differenza delle piombo-acido che traggono vantaggio dal rimescolamento, in questa pila di Daniell mischiare i due strati di elettrolita diverso potrebbe voler dire la morte della cella.
Si potrebbe ovviare caricando a tensione costante, mi apre di ricordare che la tensione di inizio elettrolsi sia 1,6V, non sò se cambia con i solfati presenti in soluzione, ma visto che la cella eroga 1,1V nominale posso azzardare che non servano più di 1,4 - 1,5V per ricaricarla.
Un dubbio che mi sorge ora è come fare a capire i due estremi di scarica profonda e ricarica completa, seguendo il ragionamento logico delle reazioni che avvengono in fase di scarica consumiamo lo zinco, quindi se scarichiamo troppo la cella dissolviamo completamente lo zinco e non avendo più un elettrodo non possiamo più ricaricare!!!
All'opposto se ricarichiamo troppo la cella potrebbe succedere che si dissolve l'elettrodo di rame?
Un altra foto dell'epoca:









 Pages: [1]
Pages: [1] 
 Pila Zinco-Rame (Read 40956 times)
Pila Zinco-Rame (Read 40956 times)
